Waporyzacja jest obiecującym sposobem przyjmowania konopi indyjskich w medycynie. Obecnie przeprowadzono walidację 5 komercyjnych waporyzatorów pod kątem konopi zawierających THC oraz CBD.
SPIS TREŚCI
- Wprowadzenie
- Materiały i metody
- Urządzenia do waporyzacji i konfiguracja obecna w eksperymencie
- Procedury waporyzacji
- Analiza i test GC/MS
- Test HPLC
- Różnice w wynikach pomiędzy poszczególnymi waporyzatorami
- Wnioski końcowe
Do określenia przyswajalności oraz zawartości całkowitej THC (THCtot) i CBD (CBDtot) w parze zastosowano chromatografię gazową / spektrometrię.
Chromatografię cieczową z detekcją przy użyciu fotodiod zastosowano do oznaczenia ilości kannabinoidów w postaci kwasowej w pozostałościach po waporyzacji, a także do obliczenia wydajności dekarboksylacji.
Całkowity odczynnik THC i CBD z pary z 4 waporyzatorów zasilanych elektrycznie wynosił kolejno 58,4% i 51,4%, 66,8% i 56,1%, 82,7% i 70,0% oraz 54,8% i 56,7% dla Volcano Medic® (wersja atestowana Volcano Digit. Nowy model Hybrid i Hybrid/Medic 2 do zastosowań medycznych), Plenty Vaporizer®, Arizer Solo® i DaVinci Vaporizer®.
Skuteczność dekarboksylacji była precyzyjna dla THC w stosunku (≥ 97,3%) i CBD (≥ 94,6%). Vape-or-Smoke ™ zasilany gazem wykazał współczynnik THCtot i CBDtot w oparach o wyniku 55,9% i 45,9% przy zachowanej skuteczność dekarboksylacji na poziomie ≥ 87,7 dla obu kannabinoidów.
Jednak przy waporyzacji za pomocą tego urządzenia zaobserwowano spalanie konopi. Waporyzatory o kontrolowanej temperaturze, zasilane elektrycznie, skutecznie dekarboksylują nieaktywne kannabinoidy w postaci kwasowej i niezawodnie uwalniają odpowiadające im neutralne, aktywne kannabinoidy.
W ten sposób oferują bardzo obiecujący sposób aplikacji. Z pewnością taka metoda sprzyja bezpiecznemu i skutecznemu przyjmowaniu marihuany medycznej.
Wprowadzenie
Konopie mają niepowtarzalną i bardzo długą historię. Pierwsze uprawy zostały zapoczątkowane w Chinach w czasach neolitu 6000 lat temu.
W tamtym okresie konopia była wykorzystywana jako ważna roślina włóknista pod kątem produkcji ubrań, a także jako składnik lekarstw.
Dokładna naukowa ocena medycznego potencjału konopi sięga prac badawczych Sir Williama B. O’Shaughnessy’ego w latach 1838–1840.
We wczesnych latach sześćdziesiątych XX wieku zidentyfikowano kannabidiol (CBD) i najbardziej psychoaktywny kannabinoid delta-9-tetrahydrokannabinol, czyli popularne THC.
Do 2009 roku odkryto ponad 525 substancji znajdujących się w konopiach, w tym około 100 różnych kannabinoidów. Lata 80. i wczesne lata 90. zaowocowały natomiast odkryciem receptora kannabinoidowego 1 (CB1R) w tkance mózgowej oraz receptora kannabinoidowego 2 (CB2R).
W ostatnich latach wykazuje się coraz więcej dowodów na to, że układ receptorów kannabinoidowych odgrywa kluczową rolę w regulacji różnych funkcji dla utrzymania homeostazy w organizmie.
Podjęto wiele prób łagodzenia i leczenia objawów przy pomocy substancji zawartych w konopiach w różnych chorobach poprzez aktywację lub hamowanie receptorów kannabinoidowych.
THC jest dostępne w wielu krajach jako środek leczniczy. Jest podawany doustnie w formie leku o nazwie dronabinol, stosowanym w leczeniu bólu, nudnościach i przy utracie apetytu.
Udowodniono także, że THC jest niezwykle skuteczne w przypadku pacjentów cierpiących na raka, stwardnienie rozsiane, stwardnienie zanikowe boczne, przewlekły ból i inne choroby.
Jednak THC może także powodować w zależności od dawki psychotropowe skutki uboczne. Jednocześnie zaobserwowano rosnące zainteresowanie medycznym zastosowaniem konopi indyjskich.
Poza THC, inne kannabinoidy, a także związki nie będace kannabinoidami, takie jak terpenoidy, najprawdopodobniej przyczyniają się do ogólnego działania farmakologicznego konopi na ciało człowieka i modulują je.
Wiele ostatnich badań potwierdziło przeciwzapalne i neuroprotekcyjne właściwości THC oraz CBD. Ponadto CBD zmniejsza psychotropowe skutki THC. Dodatkowo THC i CBD działają synergicznie.
Ważnym aspektem zastosowania kannabinoidów w medycynie i oceny metod podawania są właściwości farmakokinetyczne tych silnie lipofilnych związków.
W porównaniu z bardzo szybkim i dobrym wchłanianiem po podaniu do płuc, wchłanianie po podaniu doustnym jest powolne, nieprzewidywalne i nieregularne.
Odsetek 6–20% wskazuje na bardzo niską ogólnoustrojową biodostępność THC i innych kannabinoidów po podaniu doustnym, co spowodowane jest wrażliwością THC na odczyn kwasowy płynu żołądkowego i długi proces metaboliczny w jelitach oraz wątrobie.
Ponadto stwierdzono, że biodostępność po podaniu doustnym jest bardzo indywidualna w stosunku do każdego przyjmującego.
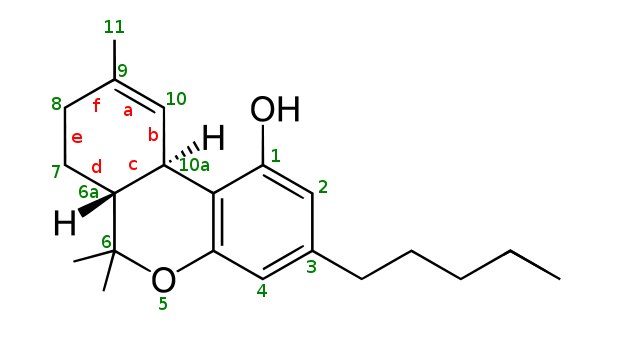
Stwierdzono również, że po podaniu doustnym stężenie THC we krwi stanowiło jedynie 25–30% zawartości występujących we krwi badanego po przyjęciu tej samej dawki za pomocą wchłaniania przez wdechy.
W przypadku wystąpienia pogorszonej farmakokinetyki doustnego podania kannabinoidów, niezbędne są alternatywne metody aplikacji.
Farmakokinetyka to dziedzina farmakologii opisująca zmiany stężenia leku lub jego metabolitów w ustroju w czasie. Pod tym kątem sposoby przyjmowania, takie jak inhalacja poprzez waporyzację konopi lub kannabinoidów okazuje się o wiele bardziej wydajna.
Jest to skuteczny i mniej szkodliwy tryb przyjmowania, a wchłanianie się kannabinoidów przez płuca jest nie tylko efektywniejsze, ale statystycznie, bardziej korzystne z perspektywy pacjentów, którzy nie są w stanie połykać.
W przypadku osób cierpiących na ciężkie schorzenia dróg oddechowych należy jednak dokładnie rozważyć zastosowanie waporyzatorów.
W takich przypadkach alternatywną opcją mogą być marihuana aplikowana bezpośrednio przez śluzówkę jamy ustnej bądź preparaty kannabinoidowe w postaci sprayów podjęzykowych bądź tabletek.
Waporyzatory dekarboksylują kwasy kannabinoidowe w temperaturze około 200° C i uwalniają obojętne, lotne kannabinoidy, które dostają się do układu krążenia ogólnoustrojowego poprzez wchłanianie z pary w płucach.
Odparowanie niepirolityczne pozwala uniknąć tworzenia się niebezpiecznych produktów spalania, takich jak substancje smoliste, złożone węglowodory aromatyczne (WWA), tlenek węgla i czynniki rakotwórcze (np. benzen).
Badacze tacy, jak Gieringer wskazali na zalety waporyzacji konopi w porównaniu z paleniem i wykazali, że tworzenie się produktów spalania jest prawie całkowicie stłumione w przypadku korzystania z waporyzatorów.
Jednak efektywność uwalniania kannabinoidów do pary jest uzależnione od konkretnego urządzenia. Od 36% do 61% THC obecnego w konopiach zostało stwierdzonych w parze uzyskanej przy użyciu waporyzatora Volcano Medic® w temperaturze 226° C.
W parze znaleziono jedynie 3 nie-kannabinoidy. Z kolei w dymie ze spalonych konopi zidentyfikowano około 150 szkodliwych substancji chemicznych, w tym 5 silnie rakotwórczych.
Doktor Fischedick dokonał w tym celu wszechstronnego porównania dymu z konopi indyjskich i pary z konopi uzyskanej przy użyciu waporyzatora Volcano Medic®.
Wykazał brak produktów pirolizy w parze w temperaturze 200° C oraz zawartość kannabinoidów wyższą w przypadku korzystania z waporyzatora niż palonego suszu CBD/THC. Kilka innych grup przeprowadziło wszechstronną ocenę efektywności Volcano Medic®.
Hazekamp zdefiniował optymalne parametry waporyzacji konopi. W zależności od temperatury THC w różnych proporcjach przedostaje się do pary.
To samo zostało wykazane przez Pomahacova i jego asystentów, którzy stwierdzili najwyższy współczynnik THC i optymalny stosunek kannabinoidów do szkodliwych produktów ubocznych w 230° C.
Oceny farmakokinetycznej i farmakodynamicznej tego samego waporyzatora dokonał również Abrams. Wskazał on, że wyniki farmakokinetyczne i farmakodynamiczne między paleniem a waporyzacją konopi są porównywalne jedynie gdy powstawanie tlenku węgla jako wskaźnika spalania zostało całkowicie stłumione przy użyciu waporyzatora.
Skuteczność wziewnego wchłaniania THC została również udowodniona przez Naefa i doktorantów, którzy porównali stosunek THC podanego dożylnie z wchłanianym przez płuca.
THC w postaci ciekłego aerozolu z ciśnieniowego nebulizatora był o wiele bardziej efektywny. Dalsze dane farmakodynamiczne potwierdzające skuteczność wchłaniania płucnego pochodzą z czystego THC waporyzowanego z Volcano Medic®.
Ponadto dowody na przydatność kliniczną i zalety waporyzacji THC jako alternatywy palenia, zostały wykazane w 2 badaniach objawów płucnych.
W jednym z nich stwierdzono na podstawie kwestionariusza znaczne zmniejszenie problemów związanych z oddychaniem, takie jak kaszel, flegma i ucisk w klatce piersiowej u osób, które zaczęły waporyzować konopie.
W innym badaniu monitorowano czynność płuc za pomocą spirometrii u palaczy konopi indyjskich przed i po zastosowaniu waporyzatora. Pomiar wykazał poprawę i normalizację czynności płuc w ciągu miesiąca od zaprzestania palenia.
Waporyzator Volcano Medic® jest obecnie jedynym waporyzatorem, który został gruntownie przetestowany pod kątem waporyzacji konopi zgodnie ze standardami naukowymi.
Jak dotąd nie opublikowano żadnego porównania z innymi waporyzatorami. Dlatego celem niniejszego badania było przetestowanie działania 4 innych waporyzatorów dostępnych na rynku szwajcarskim.
Materiały i metody
Odczynniki chemiczne
Następujące deuterowane i nie deuterowane materiały wykorzystywane w badaniu zostały sprowadzone z Lipomed (Arlesheim, Szwajcaria): THC (1 mg/ml w etanolu), kannabinol (CBN; 1 mg/ml w metanolu), THCA-A (1 mg / ml w izopropanol), THC-D3 (0,1 mg/ml w etanolu) i CBN-D3 (0,1 mg/ml w metanolu).
CBD i CBD-D3 zostały zakupione od THC Pharm (Frankfurt nad Menem., Niemcy) jako standard (1 mg/ml w metanolu). Cannabichromen (CBC) pochodził z Toronto Research Chemicals (Toronto, Ontario, Kanada). CBDA dostarczyła firma ReseaChem (Burgdorf, Szwajcaria), a syntetyczny THC (dronabinol) otrzymano od firmy Hänseler (Herisau, Szwajcaria).
Wszystkie rozcieńczono w MeOH w celu uzyskania próbek kontrolnych o pożądanych stężeniach. Żeńskie kwiatostany konopi typu THC zostały dostarczone przez Bedrocan BV (Veendam, Holandia), konopie typu CBD z kolei zostały dostarczone od lokalnego hodowcy.
Wszystkie chemikalia i rozpuszczalniki posiadają czystość chemiczną w standardzie HPLC. Wkłady polipropylenowe (Chromabond, 15 ml) do ekstrakcji SPE zostały dostarczone przez Macherey-Nagel (Oensingen, Szwajcaria), a LiChroprep RP-18 (40–63 μm) pochodzi z firmy Merck.
Suszone konopie zmielono starannie w moździerzu i przechowywano w temperaturze 4° C. Pięć 100-mg próbek każdego rodzaju konopi odważono do 10-ml szklanych fiolek z zakrętkami pokrytymi teflonem (Infochroma, Zug, Szwajcaria) i połączono z 1,0 ml metanolu zawierającego 10% chloroformu (MeOH-CHCI3 9:1).
Fiolki szczelnie zamknięto, a próbki trzymano 15 minut w ultradźwiękach w temperaturze pokojowej. Po przesączeniu za pomocą pipety Pasteura z wełną szklaną, ekstrakt rozcieńczono 10 razy w MeOH. Dziesięć μl tego rozcieńczenia połączono z 25 μl roztworu (IS; THC-D3, CBD-D3 i CBN-D3; po 40 μg/ml w MeOH) i 65 μl MeOH.
Całość poddano analizie metodą chromatografii gazowej / spektrometrii (GC/MS). Do analizy metodą chromatografii cieczowej (HPLC) zastosowano 100-krotne rozcieńczenie metanolowe ekstraktu.
Roztwór metanolowy zawierający THC i CBD po 40 mg/ml przygotowano do sprawdzenia waporyzatorów. THC ostrożnie ogrzewano w 60° C gorącym powietrzem i zważono bezpośrednio do 5-ml kolby miarowej, następnie połączono z CBD i rozpuszczono w MeOH-CHCl3 9:1.
rozważ zakup w VapeFully 💜 |
 |
Urządzenia do waporyzacji i ich konfiguracja w eksperymencie
Dokonano testów na czterech waporyzatorach. Volcano Medic® i Plenty Vaporizer® zostały zakupione od Storz & Bickel (Tuttlingen, Niemcy).
Urządzenia kieszonkowe Arizer Solo® zostały zakupione od Arizer Tech (Waterloo, Kanada), DaVinci Vaporizer® od Organicix (Las Vegas, USA) i Vape-or-Smoke ™ od Elemental Technologies (Seattle, USA).
Waporyzatory były obsługiwane zgodnie z instrukcjami producenta. Temperaturę ustawiono na 210° C dla wszystkich waporyzatorów zasilanych elektrycznie. Temperatura Vape-or-Smoke ™ nie mogła być kontrolowana ani zmieniona na potrzeby eksperymentu.
Zasysanie pary przez kolumnę SPE prowadzono pod ciśnieniem 420 mbar przez 3 minuty, a następnie przez 1 minutę pod ciśnieniem 100 mbar w przypadku urządzeń kieszonkowych. Do całkowitego napełnienia balonu Volcano Medic® zastosowano 420 mbar.
Konopie zawierające 4,61% THC (THC całkowite łącznie: THC + THC powstałe w wyniku termicznej dekarboksylacji kwasów THC podczas analizy GC/MS) i konopie typu CBD z 2,60% CBD (CBD łącznie: CBD + CBD powstałe w wyniku termicznej dekarboksylacji z Kwasy CBD podczas analizy GC/MS) oraz 0,53% THCtot zostały wykorzystane do eksperymentów z waporyzacją.
Eksperymenty przeprowadzono osobno dla każdego urządzenia z 50 mg materiału konopnego w trzech powtórzeniach dla obu odmian konopi. Taką samą liczbę eksperymentów przeprowadzono z 2 mg standardów THC i CBD (50 μl THC i CBD, po 40 mg/ml w MeOH-CHCl3 9:1).
W przypadku każdego eksperymentu zebrano cztery różne typy próbek pozostawione przez: (i) parę, (ii) wszystkie części waporyzatorów, które miały kontakt z próbką lub parą, takie jak komora próbki i ustnik, (iii) pozostałość po waporyzacji oraz (iv) rurkę polipropylenową łączącą ustnik lub balon w przypadku Volcano Medic® z pompą próżniową.
Para została zamknięta w kolumnie SPE (15 ml wkład Chromabond napełniony ręcznie 1 g LiChroprep RP-18) przy użyciu pompy próżniowej Büchi B-172, wyposażonej w kontroler próżni/destylacji Büchi B-168 (Büchi Labortechnik, Flawil, Szwajcaria).
Eluaty SPE następnie oznaczono metodą GC/MS i zmierzono pod kątem zawartości THC, CBD i CBN, aby dokładniej sprawdzić skuteczność procesu dekarboksylacji i odparowania.
W ten sposób mierzono pozostałości w komorach próbek i częściach łączących po przepłukaniu MeOH-CHCl3 9:1. Przeanalizowano również wspomniane waporyzatory odpowiednio za pomocą GC/MS i dodatkowo HPLC pod kątem obojętnych i kwaśnych odczynów z kannabinoidów.
Procedury waporyzacji
Na komorę waporyzatora Volcano Medic® naniesiono cienką warstwę 50 mg konopi. Przeprowadzono waporyzację zgodnie z wskazaniami producenta. Urządzenie wstępnie podgrzano do 210 °C.
Balon po całkowitym napełnieniu podłączono do ustnika i połączono rurką polipropylenową o długości 8 cm z kolumną SPE, całość szczelnie połączono z systemem próżniowym.
Regulator podciśnienia pompy ustawiono na 420 mbarów i całą objętość balonu zassano przez kolumnę SPE. Następnie usunięto kolumnę SPE i eluowano około 4 ml MeOH-CHCl3 9:1 wykorzystując jednostkę Adsorbex SPE (Merck, Darmstadt, Niemcy).
Eluat następnie odparowano do sucha w 40 ° C pod delikatnym strumieniem azotu (TurboVap® LV, Zymark, Oftringen, Szwajcaria). Pozostałość rozpuszczono w 0,5 ml MeOH-CHCl3 9:1 i rozcieńczono w 1:10 MeOH.
Dodano 65 µl MeOH. Próbka ta została następnie przeanalizowana za pomocą GC/MS w celu oznaczenia zawartości THC, CBD i CBN. Ustnik,komorę próbki i rurkę łączącą ustnik z kolumną SPE starannie, oddzielnie przepłukano 5 ml MeOH-CHCl3 9:1.
Próbki odparowano w strumieniu azotu w 40° C i w 0,5 ml MeOH-CHCl3 9:1, jak opisano powyżej. Z każdej próbki przygotowano 10-krotne rozcieńczenie, dodając 25 μl IS i 65 μl MeOH do 10 μl próbki.
Pozostały materiał roślinny z komory próbki ekstrahowano w 0,5 ml MeOH-CHCl3 9:1, jak opisano powyżej w celu określenia ilości materiału testowego z konopi. 25 µl IS i 65 µl MeOH dodano do 10 µl przesączonego ekstraktu i przeanalizowano metodą GC/MS.
Ten sam ekstrakt rozcieńczono w 1:10 MeOH i poddano analizie HPLC. W celu walidacji urządzenia ze standardami kannabinoidów, 50 μl roztworu wzorcowego (THC i CBD, po 40 mg/ml w MeOH-CHCl3 9:1) ostrożnie umieszczono na metalowej podkładce z płynem, zaprojektowanej specjalnie przez producenta.
Z komory próbki wyjęto 2 sita i zamontowano w niej podkładkę z płynem. Komorę próbki podłączono do podgrzanego Volcano Medic® z temperaturą ustawioną na 100 ° C i włączono wentylator na 45 sekund w celu usunięcia rozpuszczalników.
Następnie komorę próbki wyjęto z urządzenia i podłączono do balonu, w momencie gdy temperaturę podwyższono do 210° C.
Po osiągnięciu 210° C komorę próbki wraz z balonem podłączono ponownie do urządzenia i zastosowano tę samą procedurę. Zastosowano delikatny strumień azotu w celu odparowania rozpuszczalnika w temperaturze 40° C, próbkę rozpuszczono w 0,5 ml MeOH-CHCl3 9: 1 i potraktowano GC/MS oraz HPLC po 10-krotnym rozcieńczeniu, jak w przypadku innych próbek.
Plenty Vaporizer® badano na najwyższym ustawieniu temperatury (poziom 7) odpowiadającym 210° C.
Komorę wypełniono próbką 50 mg konopi. W celach badawczych 50 μl roztworu z kannabinoidów naniesiono na bibułę filtracyjną (Schleicher & Schuell, Dassel, Niemcy) przyciętą do rozmiaru próbki.
Rozpuszczalnik odparowano pod delikatnym strumieniem azotu w temperaturze pokojowej, a bibułę filtracyjną umieszczono w komorze próbki.
Ustnik zamocowany na końcu rurki chłodzącej urządzenia został usunięty, natomiast rurka została bezpośrednio podłączona do kolumny SPE. Komorę z próbką zamontowano na parowniku.
Gdy tylko temperatura przekroczyła 205° C, włączono pompę próżniową i rozpoczęto zasysanie przez 3 min przy ciągłym przepływie z regulatorem próżni ustawionym na 420 mbar, a następnie przez 1 min przy 100 mbar.
Przygotowanie próbek różnych frakcji przeprowadzono zgodnie z wytycznymi dla waporyzatora Volcano Medic®. Lamele rurki chłodzącej w szczególności musiały zostać bardzo dokładnie przepłukane.
Bibułę filtracyjną wykorzystywaną do odparowywania wzorców poddano działaniu ultradźwięków przez 15 minut przy wystarczającej zawartości MeOH-CHCl3 9:1.
Rozpuszczalnik odparowano pod delikatnym strumieniem azotu w 40° C, próbkę odtworzono w 0,5 ml MeOH-CHCl3 9:1 i ponownie przetestowano za pomocą GC/MS i HPLC.
W celu walidacji waporyzatora Arizer Solo® temperaturę waporyzacji ustawiono na najwyższy poziom (7), który zgodnie z instrukcją producenta odpowiada 210° C.
Prostą szklaną rurkę połączono 8 cm polipropylenową rurką z kolumną SPE. W rurze umieszczono kawałek waty szklanej, aby zakryć stosunkowo duże otwory w przegrodzie, oddzielając górną część rury od komory próbki, aby uniknąć zasysania materiału testowanego przez podciśnienie.
W celu walidacji ze standardami kannabinoidów, 50 μl (2 mg) roztworu metanolowego ostrożnie naniesiono na bawełnianą kulkę (10±2 mg).
Rozpuszczalnik z osadu usunięto w temperaturze pokojowej pod delikatnym strumieniem azotu. Włączono grzałkę, a szklaną rurkę wstępnie wypełnioną badanymi materiałami, zamontowano w urządzeniu i natychmiast po osiągnięciu odpowiedniej temperatury uruchomiono pompę próżniową.
Zasysanie pary przez kolumnę SPE prowadzono, jak opisano dla Plenty Vaporizer®, przez 3 minuty przy 420 mbar, a następnie przez 1 minutę przy 100 mbar.
Próbki frakcji uzyskano i przetworzono zgodnie ze szczegółowym opisem dla waporyzatora Volcano Medic®.
Osad bawełny wykorzystany do odparowania wzorców ekstrahowano przy użyciuu MeOH-CHCl3 9:1 i zastosowanie fal ultradźwiękowych przez 15 minut, a następnie odparowano rozpuszczalnik w azocie w 40° C. Pozostałość w 0,5 ml MeOH -CHCl3 9:1 poddano analizie metodą GC / MS i HPLC.
DaVinci Vaporizer® ustawiono bazowo na temperaturę 210° C. Ustnik połączono 8 cm rurką polipropylenową z kolumną SPE.
Komorę załadowano 50 mg konopi. W celu walidacji ze standardami kannabinoidów, 50 μl (2 mg) roztworu wzorcowego przeniesiono do puszki po olejku dostarczonej wraz z urządzeniem.
Puszkę oleju włożono do komory próbki. Aby usunąć rozpuszczalnik, włączono grzałkę z temperaturą ustawioną na 100 ° C i komorę próbki pozostawiono otwartą przez 1 minutę po osiągnięciu temperatury.
W celu odparowania konopi lub kannabinoidów komora próbki załadowana badanymi materiałami została zamknięta, a grzałka włączona.
Pompę próżniową włączono natychmiast po osiągnięciu 210° C i zbieranie oparów przeprowadzono jak opisano powyżej dla Plenty Vaporizer®.
Urządzenie zostało zdemontowane, a frakcje próbek zebrano, przetworzono i przeanalizowano zgodnie ze szczegółowymi wytycznymi dla Volcano Medic®.
W celu walidacji Vape-or-Smoke ™ na komorę próbki nałożono 50 mg konopi lub 2 mg (50 μl) wzorców kannabinoidowych.
Do waporyzacji wzorców kannabinoidów zastosowano tę samą procedurę z użyciem granulatu bawełnianego, co w przypadku waporyzatora Arizer Solo®.
Ustnik waporyzatora połączono za pomocą 8 cm polipropylenowej rurki z kolumną SPE, a kolumnę SPE połączono z pompą próżniową.
Pompa próżniowa pracowała przy ciągłym przepływie ustawionym na 420 mbar przez 3 minuty, podczas gdy płomień butanowy parownika był pośrednio zapalany w 6 cyklach na minutę, każdy po 3 sekundy.
Na koniec regulator próżni ustawiono na 100 mbar i waporyzację kontynuowano jeszcze przez 1 minutę, stosując tę samą procedurę pośrednią.
Frakcje próbki zebrano, przetworzono i przeanalizowano zgodnie ze szczegółowym opisem dla waporyzatora Volcano Medic®.
Granulki bawełny użyte do odparowania wzorców kannabinoidów zostały wyekstrahowane w sposób opisany dla waporyzatora Arizer Solo®.
Analiza i test GC/MS
W tym celu wykorzystano chromatograf gazowy HP 5890 II wyposażony w próbnik HP 6890 i selektywny detektor masowy HP 5972 (MSD) (Agilent Technologies, Palo Alto, CA, USA).
Próbki o objętości 1 μl wstrzyknięto bez rozszczepienia na kolumnę kapilarną Agilent DB-1MS (25m x 0,25 mm id, folia 0,25 μm). Po zrównoważeniu kolumny przez 0,5 min, całość poddano oddziaływaniu temperatur: w 100 °C przez 1 min, w 25 °C/min do 175 ° C, przy 5 °C/min do 200 °C i ostatecznie przy 10 °C/min do 300 °C (całkowity czas pracy 18 minut).
Temperatura wtryskiwacza, linii przesyłowej i źródła jonów wynosiły odpowiednio 250, 280 i 166° C. Hel zastosowano jako gaz nośny przy stałym natężeniu przepływu 1,0 ml/min (67 kPa w 100 °C).
System MS pracował w standardowym zderzeniu elektronowym (70 eV, prąd emisji 35 μA) połączonym z wybranym monitorowaniem jonów w SIM. MSD działało między 3,5 a 18,0 min, rejestrując 3 grupy jonów odpowiadające za CBD (3,5–14,9 min), THC (14,9–15,6 min) i CBN (15,6–18,0 min).
Kwalifikator (czas przebywania 60 ms) i jony kwantyfikujące (czas 100 ms) dla CBD i CBD-D3 (IS) wynosiły odpowiednio m/z 246 i 231 oraz 249 i 234. Dla THC i THC-D3 (IS) kwalifikator (czas przebywania 40 ms) i jony kwantyfikujące (czas przebywania 80 ms) wynosiły odpowiednio m / z 314, 299 i 231 i 317, 302 i 234. Dla CBN i CBN-D3 (IS) kwalifikator (czas przebywania 40 ms) i jony kwantyfikatora (czas przebywania 80 ms) wynosiły odpowiednio m / z 310, 238 i 295 i 313, 241 i 298.
Do obsługi waporyzatora, rejestracji danych i analizy wykorzystano oprogramowanie ChemStation G1701BA w wersji B.00.00 Agilent. Obliczenia oparto na kalibracji wewnętrznej i regresji liniowej.
Kalibratory i próbki kontroli jakości zawierające THC, CBD i CBN przygotowano z dostępnych roztworów wzorcowych poprzez rozcieńczenie MeOH i dodanie odpowiednich deuterowanych wzorców jako IS przy 10 μg/ml.
Przygotowano trzy zestawy kalibracyjne i mierzono je przez 3 różne dni, obejmując 1–250 μg/ml dla CBD i CBN oraz 2–250 μg/ml dla THC. Dziewięć różnych stężeń kalibratora zastosowano dla CBD i CBN (1, 2, 5, 10, 20, 50, 100, 150 i 250 μg/ml) i 8 (2, 5, 10, 20, 50, 100, 150 i 250 μg/ml) dla THC.
Do walidacji testu i monitorowania stabilności metody podczas analizy próbek zastosowano cztery poziomy próbek kontrolnych (3, 15, 40 i 130 μg/ml).
Walidację metody przeprowadzono poprzez określenie dokładności, precyzji i dolnej granicy wykrywalności (LLOQ; S/N = 10).
Dane dotyczące precyzji i dokładności w ciągu dnia (n = 5) i pomiędzy nimi (n = 5) uzyskano dla próbek kontrolnych przy użyciu 4 poziomów stężeń (3, 15, 40 i 130 μg/ml).
Test HPLC
System HPLC z serii Agilent 1100 (Agilent Technologies do kolumny SPE. Komorę na próbki załadowano 50 mg konopi.
W celu walidacji ze standardami kannabinoidów, 50 μl (2 mg) roztworu wzorcowego przeniesiono do puszki po olejku dostarczonej wraz z waporyzatorem. Całość włożono do komory próbki.
Aby usunąć rozpuszczalnik, włączono grzejnik z temperaturą ustawioną na 100 °C i komorę próbki pozostawiono otwartą przez 1 minutę po osiągnięciu temperatury.
W celu odparowania konopi lub kannabinoidów komora próbki załadowana badanymi materiałami została zamknięta, a grzałka włączona.
Pompę próżniową włączono natychmiast po osiągnięciu 210 °C, a zbieranie pary przeprowadzono jak opisano powyżej dla waporyzatora Plenty Vaporizer®.
Waporyzator został oczyszczony, a frakcje próbek zebrano, przetworzono i przeanalizowano zgodnie z wytycznymi dla Volcano Medic®.
W celu walidacji Vape-or-Smoke ™ do komory włożono 50 mg konopi lub 2 mg (50 μl) kanabinoidów.
Do waporyzacji zastosowano tę samą procedurę z użyciem granulatu bawełnianego, co w przypadku Arizer Solo®. Ustnik parownika połączono za pomocą 8 cm polipropylenowej rurki z kolumną SPE, a kolumnę SPE połączono z pompą próżniową.
Pompa próżniowa pracowała przy ciągłym przepływie z regulatorem próżni ustawionym na 420 mbar przez 3 minuty, podczas gdy płomień parownika był pośrednio zapalany w 6 cyklach na minutę, każdy po 3 sekundy.
Na koniec regulator próżni ustawiono na 100 mbar i odparowanie kontynuowano jeszcze przez 1 minutę, stosując identyczną procedurę pośrednią.
Frakcje próbki zebrano, przetworzono i przeanalizowano zgodnie ze szczegółowymi wytycznymi waporyzatora Volcano Medic®. Granulki bawełny wykorzystane do odparowania wzorców kannabinoidów zostały wyekstrahowane w sposób opisany dla waporyzatora Arizer Solo®.
Różnice w wynikach pomiędzy poszczególnymi waporyzatorami
W przypadku waporyzacji przy użyciu Volcano Medic®, ponad 58% THCtot znajdowało się w parze. Natomiast zawartość CBDtot była nieco niższa i wynosiła 51,4%.
Z drugiej strony stopień efektywności parowania THC i CBD był odpowiednio o 64,0 i 73,3% wyższy, a ilość kannabinoidów pozostających w komponentach urządzeń była znacznie niższa.
Przyczyną może być to, że wzorce kannabinoidowe znajdowały się w komorze próbki bezpośrednio na podkładce metalowej przeznaczonej do cieczy, ułatwiając przy tym parowanie wzorców testowych.
Wartości RSD THCtot i CBDtot w próbkach oparów wynosiły odpowiednio od 10% do 13% i od 3,6% do 10%. W czasie waporyzacji standardów kannabinoidowych zawartość CBD była wyższa niż THC. THC i CBD pozostawione w pozostałościach po waporyzacji wynosiły ≤ 15% i <3% odpowiednio dla konopi i kannabinoidów.
Zmienność ilości kannabinoidów zawartych w pozostałościach była zależna od odsetku wszystkich kannabinoidów znalezionych w tych próbkach.
Konsekwentnie, wartości RSD były najwyższe i sięgały 94,2% dla wzorców kannabinoidów z najniższą zawartością pozostałą w resztkach. Tylko niewielki procent wynoszący ≤ 3,6% wszystkich kannabinoidów osadził się na częściach urządzenia (tj. komorze próbki, zaworze łączącym i ustniku).
Nie mierzono kannabinoidów zaadsorbowanych w balonie, co może być jednym z wyjaśnień, dlaczego stwierdzono, że suma wszystkich frakcji wynosi od 64,6% do 76,5% przy RSD <11,4%.
Odzysk w parze uzyskanej z waporyzatora Plenty Vaporizer® wynoszący 50,7 do 66,8% był podobny do tego z Volcano Medic®.
W tym urządzeniu do inhalacji nie zaobserwowano różnic między marihuaną i kannabinoidami. Wartości RSD były znacznie niższe niż wartości Volcano Medic®, co wskazuje na wiarygodne i ilościowe uwalnianie kannabinoidów z matrycy próbki.
Z 1,1% do 2,1% (konopie indyjskie) i 0,4% (kannabinoidy) znacznie mniej kannabinoidów pozostało w pozostałościach po waporyzacji z Plenty Vaporizer® w porównaniu z Volcano Medic®.
Jednak znaczna część wszystkich kannabinoidów, od 18,7% do 25,7%, została znaleziona w częściach urządzenia. Kondensacja pary (RSD 6,1%–19,4%) powodująca osadzanie się i utratę kannabinoidów zachodzi w długiej metalowej rurce chłodzącej z lamelami zaprojektowanymi do schładzania pary przed inhalacją.
Suma kannabinoidów znaleziona we wszystkich frakcjach była najwyższa w przypadku THC waporyzowanego z konopi: od 89,6% do 92,8%.
Najwyższe wyniki uzyskano z Arizer Solo®, tj. 67,5–82,7%. Nie zaobserwowano różnic między THC i CBD.
Z wyjątkiem CBD waporyzowanego z konopi indyjskich (RSD = 11,6%) różnice były niewielka, a wartości RSD zwykle wynosiły <8%. Jedynie niewielka część ≤ 3% kannabinoidów pozostała po odparowaniu konopi indyjskich i nie znaleziono żadnych kannabinoidów w kawałku bawełny wykorzystanej do odparowania kannabinoidów.
Dodatkowe 9,8% – 13,6% THCtot i CBDtot zostało zaadsorbowanych na szklanej probówce i komorze próbki urządzenia, co daje całkowity odzysk 79,0%–98,1%.
Suma kannabinoidów znalezionych w różnych frakcjach była najwyższa dla THC waporyzowanego z konopi indyjskich, osiągnęła 88,9% przy CBD i 98,1% w konopiach typu THC.
Za wysoką efektywność może odpowiadać stosunkowo prosta konstrukcja urządzenia składająca się z gładkich powierzchni i materiałów, takich jak metal i szkło.
W parze z waporyzatora DaVinci Vaporizer® zawartość kanabinoidów wahała się od 48,5% do 56,7% i 37,3% do 47,2%, odpowiednio dla konopi indyjskich i kannabinoidów.
Pojemnik z olejkiem dostarczony z DaVinci Vaporizer® został wykorzystany do odparowania kannabinoidów rozpuszczonych w MeOH. Wprowadzenie pojemnika z olejkiem do komory próbki zmienia konstrukcję urządzenia, ponieważ musi być on podgrzany pasywnie przez komorę próbki.
Może to być przyczyną niższych rezultatów z efektywności modelu. Mniej niż 5% THCtot i CBDtot wykryto w pozostałości po odparowaniu konopi lub wzorców.
W przypadku konopi do 12,9% THC i CBD zostało zaadsorbowanych na częściach urządzenia. Przy 15,5–20,3% zanotowano więcej THC i CBD na częściach urządzenia po odparowaniu standardów kannabinoidów.
Jest to kolejna wskazówka, że włożenie oleju do komory próbki powoduje zmianę rozkładu ciepła i/lub temperatury, utrudniając w ten sposób proces parowania (waporyzacji). Przy wartości ≤ 1,3% w rurce łączącej znaleziono tylko niewielkie ilości kannabinoidów.
Całkowity odzysk jako suma wszystkich frakcji był niższy niż uzyskany z innymi parownikami i wynosił od 56,7% do 71,5%. Może to wynikać z ograniczonego uszczelnienia komory próbki.
Najważniejszą różnicą między Vape-or-Smoke™, a wszystkimi innymi testowanymi waporyzatorami jest to, że Vape-or-Smoke ™ nie jest podgrzewany elektrycznie.
Wykorzystuje on płomień butanowy. W konsekwencji temperatura nie może być regulowana ani kontrolowana.
Dlatego trudno jest utrzymać stabilne warunki doświadczalne, co przejawia się dużą zmiennością wszystkich pomiarów. 45,9% do 55,9% wszystkich kannabinoidów obecnych w konopiach zostało odzyskanych z pary z wartościami RSD między 9,7% a 37,2%. Tylko 27% do 28% wzorców kannabinoidów znajdowało się w parze, co najprawdopodobniej jest spowodowane konfiguracją eksperymentalną.
W przypadku waporyzatora Arizer Solo® próbki odparowywano z kawałka bawełny wprowadzonego do komory próbki.
Dolna część bawełny zbrązowiała podczas waporyzacji i izolowała prawdopodobnie górną część, co skutkowało niepełnym odparowaniem kannabinoidów.
W rezultacie, znaczna ilość (od 44,1% do 46,8%) kannabinoidów pozostała w próbce. W przypadku konopi w pozostałościach stwierdzono 14,4% do 16,2% kannabinoidów.
Ponownie różnice były zauważalne przy RSD. Sięgały 152,7%, co ilustruje trudności w utrzymaniu stabilnych warunków parowania.
Ogółem we wszystkich frakcjach łącznie stwierdzono od 70,3% do 85,4% wszystkich kannabinoidów i nie stwierdzono różnic między badanymi materiałami.
W wyniku wysokiej temperatury parowania stężenie CBN w parze powstałej w wyniku utleniania THC jest nieznacznie większe w porównaniu z konopiami indyjskimi.
Podczas waporyzacji konopi istotną kwestią jest skuteczna dekarboksylacja kannabinoidów w formie kwasowej, zwykle dominujących w świeżych konopiach. CBD uważa się za aktywne farmakologicznie.
W przeciwieństwie do GC/MS, gdzie derywatyzacja jest wymagana, aby zapobiec termicznej dekarboksylacji kannabinoidów w formie kwasowej, HPLC umożliwia bezpośrednią analizę kwaśnych i obojętnych kannabinoidów.
Doskonałą i niezawodną dekarboksylację THCA-A i CBDA zaobserwowano we wszystkich waporyzatorach zasilanych elektrycznie, co pozwoliło na dokładną kontrolę temperatury.
Z ≥ 99,8% Plenty Vaporizer® i DaVinci Vaporizer® wykazały najwyższe poziomy wydajności dekarboksylacji. Od 97,3% do 98,7%, podobne współczynniki dekarboksylacji stwierdzono odpowiednio w przypadku Volcano Medic® i Arizer Solo®.
Jedynie w przypadku CBD stwierdzono nieco niższą skuteczność dekarboksylacji przy waporyzacji z Volcano Medic®. Z drugiej strony Vape-or-Smoke™ działający z płomieniem butanowym wykazał niższą dekarboksylację kwaśnych kannabinoidów wynoszącą od 87,7% do 93,3%.
Ponadto stwierdzono, że zmienność dekarboksylacji z wartościami RSD do 12,7%, jest ogólnie większa w przypadku tego urządzenia, co odzwierciedla trudności w utrzymaniu stałej temperatury.
Wnioski końcowe
Medyczne zastosowanie konopi indyjskich w leczeniu lub łagodzeniu różnorodnych objawów różnych chorób wzbudza obecnie coraz większe zainteresowanie.
Jednak aplikacja doustna kannabinoidów wykazuje słabą przyswajalność, która redukowana jest dodatkowo przez procesy metaboliczne, a także kwasy żołądkowe.
Palenie konopi z kolei nie może znaleźć zastosowania w celach medycznych. Potrzebne są więc alternatywne, wydajne i mniej szkodliwe sposoby aplikacji.
Wydaje się, że taką metodą może być waporyzacja marihuany. Wyklucza ona bowiem powstawanie potencjalnie toksycznych produktów pirolizy.
W tym badaniu przeprowadziliśmy walidację 4 waporyzatorów elektrycznych i jednego waporyzatora butanowego pod kątem ich zdolności do uwalniania THC i CBD wraz z parą.
Waporyzatory zasilane elektrycznie, umożliwiające precyzyjną kontrolę temperatury, wykazały prawie całkowitą dekarboksylację kannabinoidów w formie kwasowej THCA-A i CBDA oraz dobry bądź nawet doskonały odzysk neutralnych kannabinoidów THC i CBD w oparach.
Przypadek spalania konopi, np. popiół pozostawiony w komorze na próbki i widoczny dym został stwierdzony tylko w przypadku zasilanego gazem butanowym Vape-or-Smoke™.
Przy testach tego waporyzatora zaobserwowano także zawodną dekarboksylację i waporyzację kannabinoidów w wyniku braku kontroli temperatury. Dlatego nie można polecać urządzeń zasilanych gazem w celach terapeutycznych.
Względne ilości neutralnych kannabinoidów uwalnianych do pary różniły się znacznie między 4 urządzeniami zasilanymi elektrycznie.
Największą różnicę zaobserwowano w przypadku THC waporyzowanego z konopi typu THC. Było to 54,6% i 82,7% odpowiednio dla waporyzatorów DaVinci Vaporizer® i Arizer Solo®.
Tutaj wydajność różniła się o 50% między urządzeniem z najniższą, a modelem z najwyższą wydajnością waporyzacji. Najniższe odzyskiwanie kannabinoidów z konopi indyjskich na poziomie 48,5%–58,5% uzyskano przy użyciu waporyzatorów DaVinci Vaporizer® i Volcano Medic®, podczas gdy waporyzator Plenty Vaporizer® uwolnił do pary 56,1%–66,8% wszystkich kannabinoidów.
Najlepsze wartości uzyskano w przypadku Arizer Solo®. Były to statystyki wynoszące od 70,0%–82,7%.
Zbadana także kwestie związane z dawkowaniem. Im efektywniejszy waporyzator tym mniej leku (marihuany lub kannabinoidów) potrzeba do dostarczenia pacjentowi określonej dawki terapeutycznej.
Jest to kwestia typowo ekonomiczna z punktu widzenia opłacalności terapii medycznymi konopiami. Innym aspektem jest niezawodne i stałe uwalnianie kannabinoidów do pary w celu zagwarantowania jednolitości dawkowania, co znajduje odzwierciedlenie w wartościach RSD uzyskanych dla różnych urządzeń.
Wszystkie waporyzatory napędzane elektrycznie wykazywały niewielkie zmienności z wartościami RSD ≤ 13%. Znakomite rezultaty stwierdzono w przypadku waporyzatora Plenty Vaporizer® (RSD ≤ 6,5%).
Należy również zauważyć, że konstrukcja waporyzatorów miała wpływ na ilość kannabinoidów uwalnianych wraz z parą. Im mniej skomplikowana konstrukcja, tym większa efektywność.
Podsumowując, 4 waporyzatory elektryczne, które pozwalają na waporyzację w kontrolowanej temperaturze, skutecznie dekarboksylują kwaśne kannabinoidy i efektywnie uwalniają do pary odpowiednie neutralne kannabinoidy.
Dlatego można je uznać za obiecujące pod kątem zastosowania w medycynie. W przyszłości mogą stać się podstawą, jeśli chodzi o bezpieczne i skuteczne aplikowanie marihuany leczniczej i kannabinoidów.
Jednak po obecnej walidacji wymagane są jeszcze testy kliniczne, aby potwierdzić skuteczność waporyzatorów jako narzędzi terapeutycznych.
Przypisy:
- Li H-L. Archeologiczna i historyczna relacja o marihuanie w Chinach. Econ Bot 1973; 28: 437-448. [Google Scholar]
- O’Shaughnessy WB. O preparatach konopi indyjskich (Cannabis indica); ich wpływie na układ zwierząt w zdrowiu oraz użyteczności w leczeniu tężeca i innych chorób zakaźnych. Trans Med Phys Soc Bengal 1838. –1840: 421–461. [PMC free article] [PubMed] [Google Scholar]
- Mechoulam R, Shvo Y. Hashish. I. Struktura Cannabidiol. Czworościan 1963; 19: 2073-2078. [PubMed] [Google Scholar]
- Gaoni Y, Mechoulam R. Izolacja, struktura i częściowa synteza aktywnego składnika haszyszu. J Am Chem Soc 1964; 86: 1646-1647. [Google Scholar]
- Radwan MM, Elsohly MA, Slade D, Ahmed SA, Wilson L, El-Alfy AT i in. Składniki inne niżannabinoidalne z odmiany Cannabis sativa o wysokiej mocy. Phytochemistry 2008; 69: 2627-2633. 10.1016/j.phytochem.2008.07.010 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Radwan MM, Elsohly MA, Slade D, Ahmed SA, Khan IA, Ross SA. Biologicznie czynne kannabinoidy z Cannabis sativa o wysokiej mocy. J Nat Prod 2009; 72: 906-911. 10.1021/np900067k [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Hanus LO. Pharmacological and therapeutic secrets of plant and brain (endo)cannabinoids. Med Res Rev 2009; 29: 213-271. 10.1002/med.20135 [PubMed] [CrossRef] [Google Scholar].
- Devane WA, Dysarz FA 3., Johnson MR, Melvin LS, Howlett AC. Determinacja i charakterystyka receptora kannabinoidowego w mózgu szczura. Mol Pharmacol 1988; 34: 605-613. [PubMed] [Google Scholar]
- Matsuda LA, Lolait SJ, Brownstein MJ, Young AC, Bonner TI. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Natura 1990; 346: 561–564. [PubMed] [Google Scholar]
- Munro S, Thomas KL, Abu-Shaar M. Molekularna charakterystyka obwodowego receptora dla kannabinoidów. Natura 1993; 365: 61–65. [PubMed] [Google Scholar]
- Atakan Z. 2012. Konopie indyjskie, roślina złożona: różne związki i różne oddziaływanie na osobniki. Ther Adv Psychopharmacol 2: 241-254. 10.1177/2045125312457586 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Grotenhermen F, Muller-Vahl K. Potencjał terapeutyczny konopi i kannabinoidów. Dtsch Arztebl Int 2012; 109: 495-501. [PMC free article] [PubMed] [Google Scholar]
- Ben Amar M. Cannabinoids w medycynie: Przegląd ich potencjału terapeutycznego. J Ethnopharmacol 2006; 105: 1-25. [PubMed] [Google Scholar]
- Dewey WL. Farmakologia kannabinoidalna. Pharmacol Rev 1986; 38: 151-178. [PubMed] [Google Scholar]
- Baker D, Pryce G, Giovannoni G, Thompson AJ. Potencjał terapeutyczny marihuany. Lancet Neurol 2003; 2: 291-298. [PubMed] [Google Scholar]
- Russo EB. Oswajanie THC: potencjalna synergia marihuany i efekt fitokannabinoid-terpenoidalny entourage. Br J Pharmacol 2011; 163: 1344–1364. 10.1111/j.1476-5381.2011.01238.x [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Pryce G, Riddall DR, Selwood DL, Giovannoni G, Baker D. Neuroprotection in experimental autoimmune encephalomyelitis and progressive multiple sclerosis by cannabis based cannabinoids. J Neuroimmune Pharmacol 2015; 10: 281-292. 10.1007/s11481-014-9575-8 [PubMed] [CrossRef] [Google Scholar].
- Russo E, Guy GW. Opowieść o dwóch kannabinoidach: uzasadnienie terapeutyczne połączenia tetrahydrokanabinolu i kannabidiolu. Med Hypotheses 2006; 66: 234-246. [PubMed] [Google Scholar]
- Mechoulam R, Peters M, Murillo-Rodriguez E, Hanus LO. Cannabidiol-Rodriguez E, Hanus LO. Chem Biodivers 2007; 4: 1678-1692. [PubMed] [Google Scholar]
- Agurell S, Halldin M, Lindgren JE, Ohlsson A, Widman M, Gillespie H i in. Farmakokinetyka i metabolizm delta-1-tetrahydrokanabinolu i innych kannabinoidów z naciskiem na człowieka. Pharmacol Rev 1986; 38: 21-43. [PubMed] [Google Scholar]
- Ashton CH. Pharmacology and effects of cannabis: a brief review. Br J Psychiatria 2001; 178: 101-106. [PubMed] [Google Scholar]
- Hazekamp A, Ruhaak R, Zuurman L, van Gerven J, Verpoorte R. Evaluation of a vaporizing device (Volcano) for the pulmonary administration of tetrahydrocannabinol. J Pharm Sci 2006; 95: 1308-1317. [PubMed] [Google Scholar]
- Gieringer D. Badania nad marihuaną: badania nad rurami wodnymi. MAPY 1996; 6: 59-66. [Google Scholar]
- Gieringer D. Waporyzacja marihuany: obiecująca strategia redukcji szkód spowodowanych dymem. J Cannabis Ther 2001; 1: 153-170. [Google Scholar]
- Waporyzator Gieringer D. Cannabis łączy skuteczne dostarczanie THC z efektywnym tłumieniem związków pirolitycznych. J. Cannabis Ther 2004; 4: 7-27. [Google Scholar]
- Fischedick J, Van Der Kooy F, Verpoorte R. Cannabinoid receptor 1 aktywność wiązania i analiza ilościowa dymu i oparów Cannabis sativa L.. Chem Pharm Bull (Tokyo) 2010; 58: 201-207. [PubMed] [Google Scholar]
- Pomahacova B, Van der Kooy F, Verpoorte R. Cannabis smoke condensate III: zawartość kannabinoidów w waporyzowanej Cannabis sativa. Inhal Toxicol 2009; 21: 1108-1112. 10.3109/08958370902748559 [PubMed] [CrossRef] [Google Scholar].
- Abrams DI, Vizoso HP, Shade SB, Jay C, Kelly ME, Benowitz NL. Vaporization as a smokeless cannabis delivery system: a pilot study. Clin Pharmacol Ther 2007; 82: 572-578. [PubMed] [Google Scholar]
- Naef M, Russmann S, Petersen-Felix S, Brenneisen R. Development and pharmacokinetic characterization of pulmonal and intravenous delta-9- tetrahydrocannabinol (THC) in humans. J Pharm Sci 2004; 93: 1176-1184. [PubMed] [Google Scholar]
- Zuurman L, Roy C, Schoemaker RC, Hazekamp A, den Hartigh J, Bender JC, et al. Effect of intrapulmonary tetrahydrocannabinol administration in humans. J Psychopharmacol 2008; 22: 707-716. 10.1177/0269881108089581 [PubMed] [CrossRef] [Google Scholar].
- Earleywine M, Barnwell SS. Zmniejszone objawy oddechowe u osób używających konopi indyjskich, które waporyzują. Harm Reduct J 2007; 4: 11 [PMC free article] [PubMed] [Google Scholar]
- Van Dam NT, Earleywine M. Pulmonary function in cannabis users: support for a clinical trial of the vaporizer. Int J Drug Policy 2010; 21: 511-513. 10.1016/j.drugpo.2010.04.001 [PubMed] [CrossRef] [Google Scholar].
- Food and Drug Administration. Wskazówki dotyczące walidacji przemysłowych metod bioanalitycznych. U.S. Department of Health and Human Services, Rockville, MD, 2001. Dostępny pod adresem http://www.fda.gov/downloads/Drugs/Guidances/ucm070107.pdf. [Google Scholar]
- Dussy FE, Hamberg C, Luginbuhl M, Schwerzmann T, Briellmann TA. Isolation of delta-9-THCA-A from hemp and analytical aspects concerning the determination of delta-9-THC in cannabis products. Forensic Sci Int 2005; 149: 3-10. [PubMed] [Google Scholar]
- Źródło: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4718604/











